研究成果・プレスリリース
【プレスリリース】ふりかけるだけで神経シナプスを可視化 迅速かつ簡便な標識方法開発、記憶解析や疾患研究に新たな道
2025.6.09
本研究のポイント
- 脳の記憶や学習に関わる“神経シナプス注1)”を簡便に可視化する化合物を開発
- AMPA受容体注2)を標的にすることでシナプスそのものの機能を“見る”ことが可能に
- 高度な技術不要、「ふりかけるだけ」で10秒以内に標識が完了。脳の記憶解析や疾患研究に新たな道を拓く
研究概要
我々の脳内で記憶の素子となるのは、神経細胞間の接続部分であるシナプスです。その機能を“見る”ことができれば、記憶のメカニズムの理解につながります。
名古屋大学未来社会創造機構、大学院工学研究科の清中 茂樹 教授、曽我 恭平 博士後期課程学生らのグループは、東北大学多元物質科学研究所の南後 恵理子 教授らのグループとの共同研究で、記憶や学習に必須な神経伝達物質受容体のAMPA型グルタミン酸受容体(以下、AMPA受容体)の可視化分子を開発しました。
脳内の情報伝達はシナプスという神経細胞間の接続部分で行われ、記憶が刻まれる際にはシナプスのつながりに強弱がつくことが知られています。その強弱に直接関係しているタンパク質として神経伝達物質受容体のAMPA受容体があります。すなわち、AMPA受容体を可視化することがシナプスの機能を“見る”ことにつながります。
本研究では、AMPA受容体を可視化するため、有機小分子ベースの可視化プローブPFQX1(AF488)の開発を行いました。PFQX1(AF488)は、培養皿上の細胞にふりかけるだけでAMPA受容体を可視化し、その標識は10秒以内に完了します。このような簡便さと、迅速な標識可能性を持つプローブは世界初です。さらに、この特徴を利用して、神経細胞においてAMPA受容体の詳細な動態解析にも成功しました。
本成果により、今後、脳内でいつ・どこで・どのように記憶が形成されているかを明らかにする手がかりが得られるとともに、アルツハイマー病など神経疾患の早期発見や診断への応用も期待されます。
本研究成果は、2025年6月7日午前3時(日本時間)付で米国の学術雑誌『Science Advances』に掲載されました。
名古屋大学未来社会創造機構、大学院工学研究科の清中 茂樹 教授、曽我 恭平 博士後期課程学生らのグループは、東北大学多元物質科学研究所の南後 恵理子 教授らのグループとの共同研究で、記憶や学習に必須な神経伝達物質受容体のAMPA型グルタミン酸受容体(以下、AMPA受容体)の可視化分子を開発しました。
脳内の情報伝達はシナプスという神経細胞間の接続部分で行われ、記憶が刻まれる際にはシナプスのつながりに強弱がつくことが知られています。その強弱に直接関係しているタンパク質として神経伝達物質受容体のAMPA受容体があります。すなわち、AMPA受容体を可視化することがシナプスの機能を“見る”ことにつながります。
本研究では、AMPA受容体を可視化するため、有機小分子ベースの可視化プローブPFQX1(AF488)の開発を行いました。PFQX1(AF488)は、培養皿上の細胞にふりかけるだけでAMPA受容体を可視化し、その標識は10秒以内に完了します。このような簡便さと、迅速な標識可能性を持つプローブは世界初です。さらに、この特徴を利用して、神経細胞においてAMPA受容体の詳細な動態解析にも成功しました。
本成果により、今後、脳内でいつ・どこで・どのように記憶が形成されているかを明らかにする手がかりが得られるとともに、アルツハイマー病など神経疾患の早期発見や診断への応用も期待されます。
本研究成果は、2025年6月7日午前3時(日本時間)付で米国の学術雑誌『Science Advances』に掲載されました。

研究背景
ヒトの脳内ではおよそ1000億個の神経細胞が互いに情報を交換することで、脳機能が成立しています(図1)。2つの神経細胞がつながっているサイトはシナプスといい、その結合の強弱によって記憶が定着します。例えば我々が新しい情報を記憶するとき、海馬という領域内のシナプスのつながりが強くなります。また、運動機能を記憶するときは、小脳のシナプスのつながりが弱くなることが知られています。それぞれは長期増強(LTP)、長期抑圧(LTD)と呼ばれます注3)。このように、シナプスは記憶の素子として働いています。したがって、シナプスの機能を解析することが記憶のメカニズムの解明につながります。
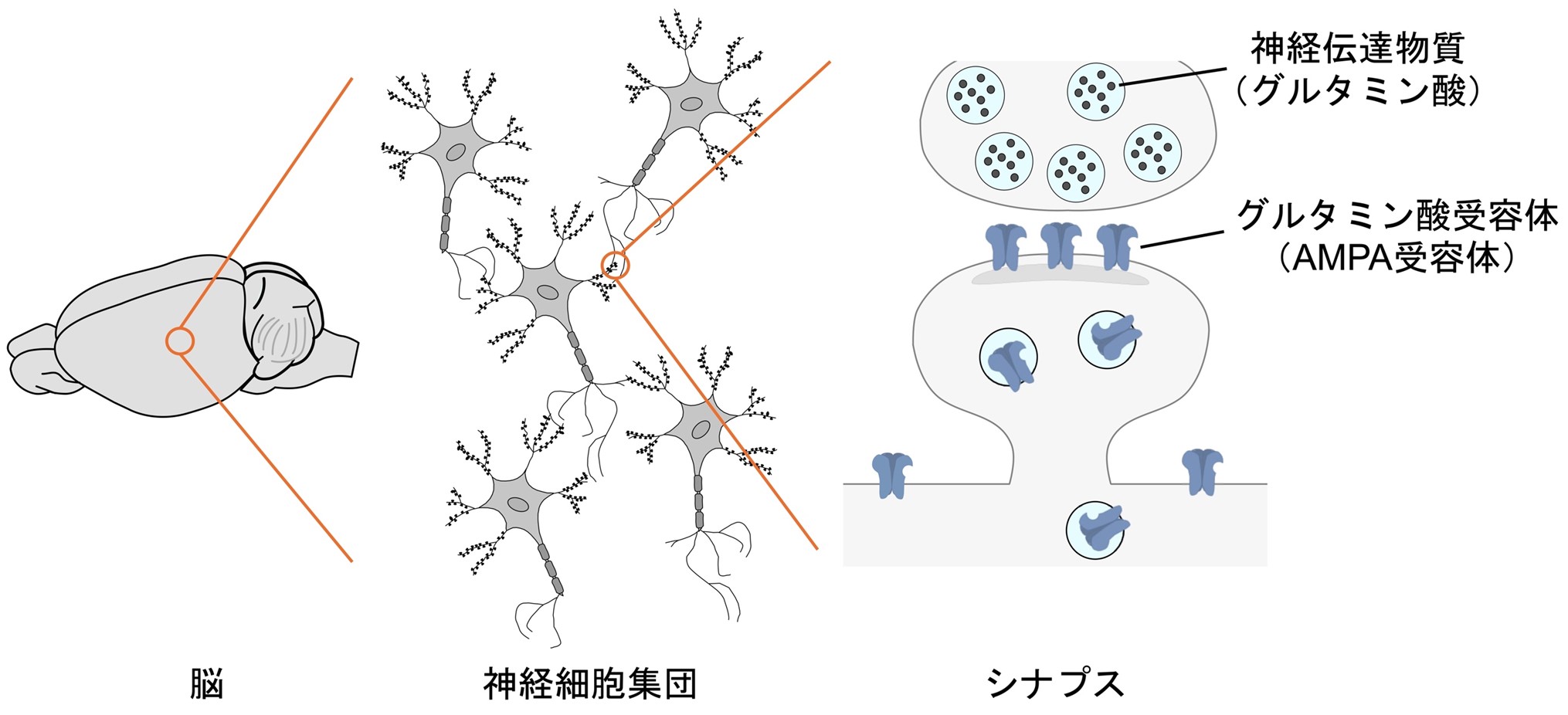
図1. 脳は多数の神経細胞によって構成されている。神経細胞間の情報伝達はシナプスというサイトで行われており、シナプス内では多数のタンパク質が連関しながら機能を発現する。
グルタミン酸は脳内で興奮性の情報伝達を担う重要な神経伝達物質です。グルタミン酸はシナプスにおいてやり取りが行われており、受け取るタンパク質としてAMPA受容体があります。AMPA受容体の活性や動態はシナプスの機能に直結しており、LTP時にはAMPA受容体の量が増え、逆にLTD時にはAMPA受容体の量は減ることが知られています(図2)。つまり、AMPA受容体の量を解析することがシナプスの機能解析につながります。
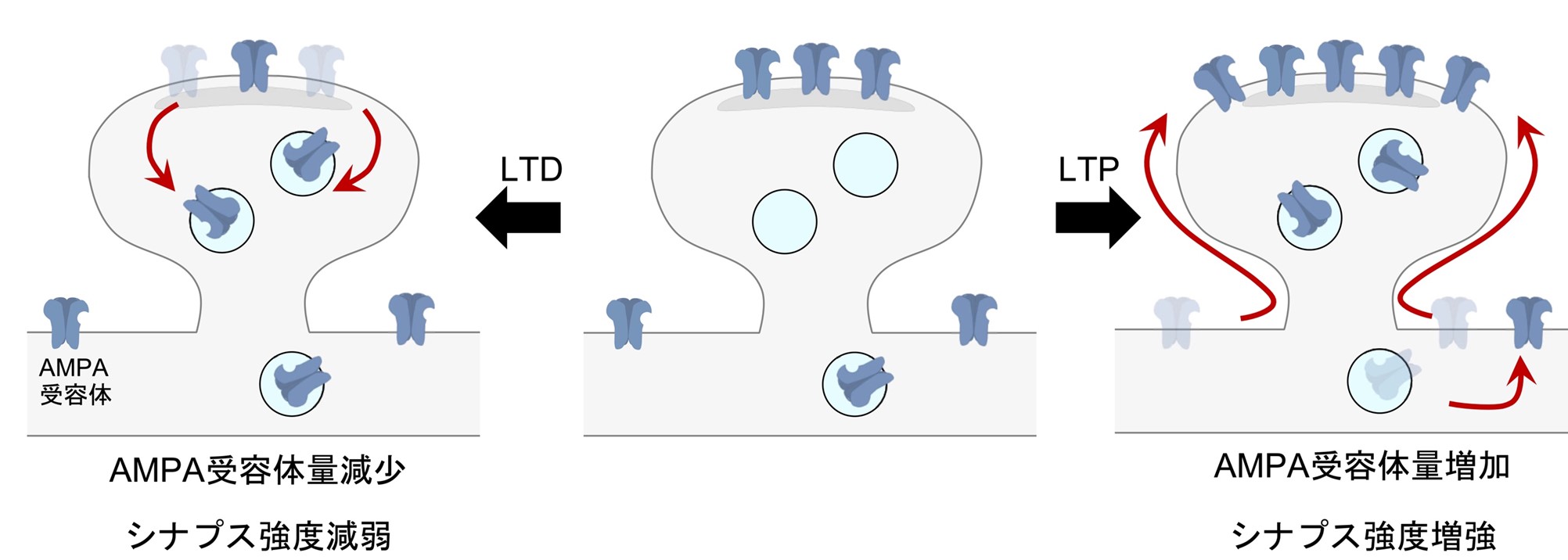
図2. LTPやLTDとAMPA受容体の発現量は密接に関係する。LTP時:AMPA受容体の発現量が増え、シナプス強度も増強する。LTD時:AMPA受容体の発現量が減り、シナプス強度は減弱する。
過去にさまざまな方法でAMPA受容体の解析が進められています。特に、緑色蛍光タンパク質(GFP)注4)をAMPA受容体に融合して観察する方法は最もメジャーであると言えます。しかし、GFPはそのサイズがAMPA受容体の4分の1程度と大きくAMPA受容体の動きに影響を与える懸念があること、またあくまでも神経細胞に加えた人工AMPA受容体の動きを見ているだけであるという点が指摘されています。もし、神経細胞にもともと発現しているAMPA受容体を観察することができれば、その受容体本来の動きの解析が可能になるとともに、シナプスの機能を“見る”ことにつながります。
研究内容
そこで本研究では、神経細胞に内在的に発現するAMPA受容体を可視化するプローブの開発を行いました(図3A)。また、その分子を用いてAMPA受容体の量が増えるメカニズムの解明に成功しました。
成果1.AMPA受容体可視化分子の開発
AMPA受容体に結合可能なリガンドと、可視化するための蛍光分子を連結したプローブを設計しました(図3B)。PFQX1(AF488)と名付けたプローブは、培養皿上の神経細胞にふりかけるだけで細胞膜上に発現するAMPA受容体を可視化することが分かりました(図3C)。また、AMPA受容体の標識にかかる時間はわずか10秒以内と、非常に迅速であることが分かりました。さらに、PFQX1(AF488)による標識はバッファーによる洗浄操作で容易に取り除くことも可能です。このように、PFQX1(AF488)はAMPA受容体を迅速かつ可逆的に可視化する分子であることが分かりました。
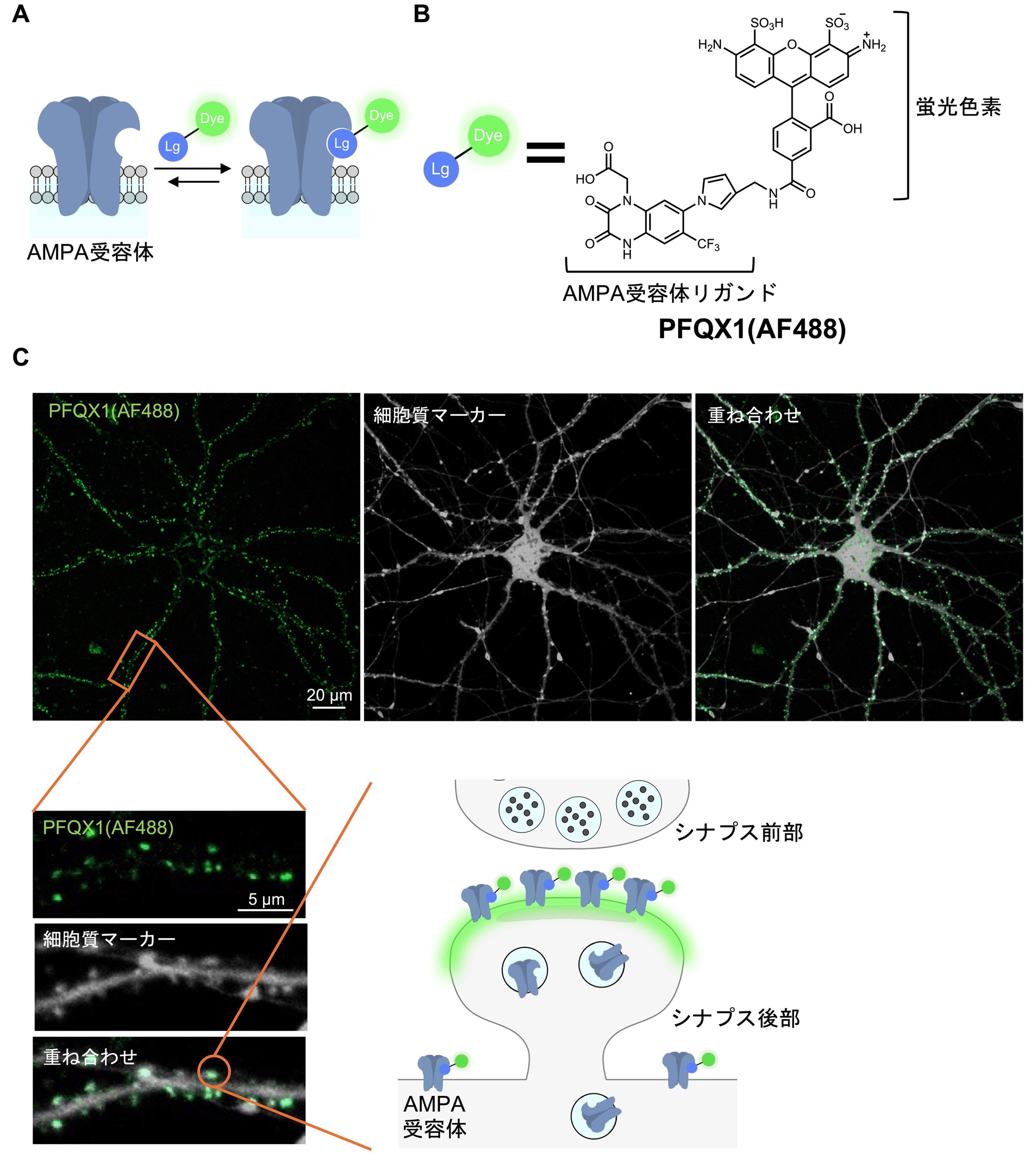
図3. 開発したプローブによるAMPA受容体の可視化。(A)PFQX1(AF488)によるAMPA受容体の可視化の模式図。(B)PFQX1(AF488)の構造式。AMPA受容体のリガンドと、蛍光色素からなる。(C)PFQX1(AF488)を用いた細胞におけるAMPA受容体の可視化。
驚くべきことにPFQX1(AF488)の結合親和性は、リガンド単体の親和性よりも高いことが明らかとなりました。その分子メカニズムを明らかにするためにX線結晶構造解析を行いました。理化学研究所の大型放射光施設SPring-8注5)にてAMPA受容体とPFQX1(AF488)の複合体構造を決定しました(図4A)。その結果、AMPA受容体のリガンドのみならず、蛍光分子がタンパク質と相互作用していることが分かりました(図4B)。このことから、蛍光分子もAMPA受容体との結合に関与しており、親和性の向上に寄与していることが分かりました。
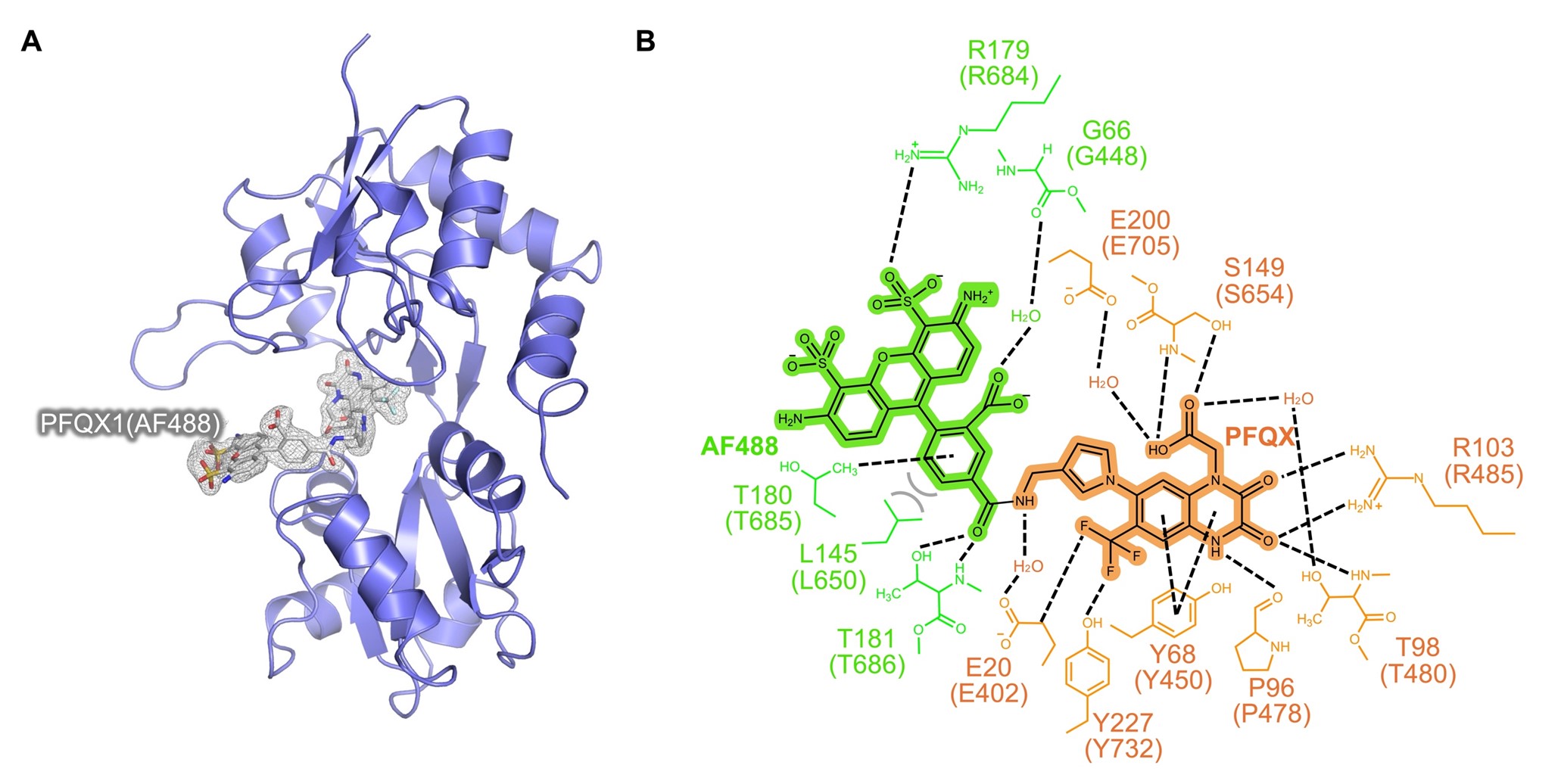
図4. PFQX1(AF488)とAMPA受容体の結晶構造。(A)複合体構造。紫色のリボン:AMPA受容体。灰色のスティック:PFQX1(AF488)。(B)PFQX1(AF488)とAMPA受容体の相互作用様式。オレンジ:リガンドおよびリガンドと相互作用するアミノ酸。緑色:蛍光色素および蛍光色素と相互作用するアミノ酸。
成果2.神経細胞を用いたAMPA受容体の動態解析
こうして得られたPFQX1(AF488)を用いて、神経細胞に内在的に発現するAMPA受容体の動態解析を行いました。そこで着目したのが、LTP時においてAMPA受容体量が増えるという現象です。しかし、AMPA受容体が増えるメカニズムには2つの経路が知られています(図5A)。1つ目は細胞内にいた成分がエキソサイトーシスによってシナプスに入ってくる経路です。2つ目はシナプス外の細胞膜上にいた成分が側方拡散によってシナプスに入ってくる経路です。これらのメカニズムについては記憶のメカニズムの根幹につながるため長年議論が交わされていますが、未だに結論は出ていません。その原因は、過去の報告のほとんどがGFPのようなタンパク質を融合した人工AMPA受容体の動態を解析しているのみで、内在的なAMPA受容体の動態を解析している訳ではないからだと考えられます。しかし、本手法では内在的に発現するAMPA受容体を解析できるため、この課題にチャレンジできると考えました。本研究グループが過去に開発したAMPA受容体の可視化方法注6)と組み合わせることでメカニズムの解明に挑みました。
薬剤によって培養皿上の神経細胞にLTPを誘導し、その前後でPFQX1(AF488)によるAMPA受容体の可視化を行いました。その結果、LTPの誘導によって蛍光強度が顕著に増大することが分かりました(図5B)。すなわち、PFQX1(AF488)によって、AMPA受容体量が増える現象を捉えることに成功しました。また、従来法と組み合わせて解析することで、AMPA受容体はLTP時にはエキソサイトーシスによってシナプス内に入ってくることを解明しました。この結果は化合物だけを用いて内在的に発現するAMPA受容体を解析した結果であり、信頼性が高いと考えています。

図5. 神経細胞におけるAMPA受容体の可視化。(A)AMPA受容体がLTP時にシナプスに侵入する経路は2つ提唱されている。1つは、細胞内の成分がエキソサイトーシスによって挿入される経路。2つ目は、シナプス外の細胞膜上にいた成分が側方拡散によって侵入する経路。(B)神経細胞のイメージング画像。LTPの誘導によって、PFQX1(AF488)の蛍光強度が増大する。つまり、AMPA受容体の量が増えていることを示している。
成果の意義
本研究で開発した可視化プローブは、ふりかけるだけで迅速にAMPA受容体を標識できる世界初の分子です。AMPA受容体を見ることはつまり、記憶の素子であるシナプスの機能を見ることにつながります。シナプスを簡便に見られることにより今後さまざまな波及効果が考えられます。
第一に、基礎研究における利用です。従来では、シナプスの機能解析を行うためには高度な技術や煩雑な操作が必要でした。しかし、本研究の可視化プローブは特別な操作が必要なく、ふりかけるだけでシナプスを標識することが可能です。またその蛍光強度の変化によってシナプス機能がどう変化したかを解析することも可能です。さらに、本研究では培養皿上の神経細胞を使用して受容体の可視化を行いましたが、動物個体の脳内で使用することも可能と考えられます。ある行動時にどこの脳領域でどのシナプスが関わって記憶が形成されているのかを見ることができます。
第二に、神経疾患の診断可能性です。多くの神経疾患はシナプス数の異常が関連することが知られています。例えばアルツハイマー病をはじめとした認知症や統合失調症の患者ではシナプスの数が減少していることが知られています。したがって、脳内でシナプスを可視化することで病気の診断につながることが期待されます。
以上のように、本研究によって基礎研究の利用にとどまらず臨床における診断のツールになることが期待されます。
用語説明
注1) シナプス
2つの神経細胞が情報伝達を行うサイト。シナプス前部とシナプス後部に分かれる。シナプス前部から神経伝達物質(グルタミン酸など)が放出され、シナプス後部の細胞膜上に存在する神経伝達物質受容体が受け取る。
注2) AMPA受容体
神経伝達物質受容体の1つであり、シナプス後部に発現する。グルタミン酸を受け取り、Na+やK+といった陽イオンを透過するイオンチャネルである。また、細胞膜上における発現はダイナミックに変化しており、シナプス可塑性時に増減することが知られる。
注3) LTP、LTD
シナプスにおける情報伝達はさまざまな刺激によって強弱がつくことが知られる。その現象をシナプス可塑性と呼び、記憶の細胞基盤となる。情報伝達が促進される機構が長期増強(LTP)、減弱する機構が長期抑圧(LTD)である。また、シナプス可塑性には、シナプス前部からの神経伝達物質の放出確率が変化する、シナプス前部性の現象と、シナプス後部において神経伝達物質を受け取る効率が変化する、シナプス後部性の現象が知られている。本研究では、シナプス後部性の現象を見ている。
注4) 緑色蛍光タンパク質(GFP)
名古屋大学出身の下村脩先生が発見した、オワンクラゲ由来のタンパク質。2008年のノーベル化学賞を受賞。GFPは青色光を当てると緑色の蛍光を発するため、標的タンパク質に融合することで蛍光可視化が可能となる。
注5) 大型放射光施設SPring-8
理化学研究所が所有する兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す大型放射光施設。SPring-8(スプリングエイト)の名前はSuper Photon ring-8 GeVに由来。SPring-8では、放射光を用いてナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。
注6) 過去に開発したAMPA受容体の可視化方法(二段階ラベル化法)
神経細胞に内在的に発現するAMPA受容体を可視化可能な方法(Nature Communications誌に2021年に掲載済み)。PFQX1(AF488)による可視化とは異なり、受容体を共有結合的に修飾する。そのため、受容体の動きを長時間にわたって見ることに優れている。
研究プロジェクトについて
本研究成果は、日本学術振興会 科研費 (JP22KJ1605, JP24H02262, JP24H00547, JP24H02265, JP24H00492)、JST CREST (JPMJCR1854)、JST ERATO (JPMJER1802)、日本医療研究開発機構(AMED)ムーンショット型研究開発事業目標7「グリア病態からセノインフラメーションへ発展する概念に基づく認知症発症機序の早期検出と制御」、ノバルティス科学振興財団、武田科学振興財団の助成を受けたものです。
*AMEDでは、ムーンショット型研究開発事業の目標7「2040年までに、主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムの実現」の達成にむけて研究開発を推進しています。
*AMEDでは、ムーンショット型研究開発事業の目標7「2040年までに、主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムの実現」の達成にむけて研究開発を推進しています。
論文情報
雑誌名:
“Science Advances”
タイトル:“Rapid and reversible fluorescent probe enables repeated snapshot imaging of AMPA receptors during synaptic plasticity”
著者名:
著者名:
Kyohei Soga, Takaaki Fujiwara, Mayu Nakagawa, Akihiro Shibata, Hansel Adriel, Kenji Yatsuzuka, Wataru Kakegawa, Michisuke Yuzaki, Itaru Hamachi, Eriko Nango+, Shigeki Kiyonaka+ +Corresponding author
(曽我恭平、藤原孝彰、中川満結、柴田晃大、Hansel Adriel、八塚研治、掛川渉、柚崎通介、浜地格、南後恵理子+、清中茂樹+ +責任著者)
DOI:10.1126/sciadv.adt6683
(曽我恭平、藤原孝彰、中川満結、柴田晃大、Hansel Adriel、八塚研治、掛川渉、柚崎通介、浜地格、南後恵理子+、清中茂樹+ +責任著者)
DOI:10.1126/sciadv.adt6683
関連リンク
問い合わせ先
【研究に関すること】
東北大学 多元物質科学研究所
教授 南後恵理子
教授 南後恵理子
TEL: 020-217-5344
Email: eriko.nango.c4*tohoku.ac.jp
Email: eriko.nango.c4*tohoku.ac.jp
【報道に関すること】
東北大学 多元物質科学研究所 広報情報室
TEL: 022-217-5198
Email: press.tagen*grp.tohoku.ac.jp
TEL: 022-217-5198
Email: press.tagen*grp.tohoku.ac.jp
【AMED事業に関すること】
日本医療研究開発機構(AMED)
シーズ開発・基礎研究事業部挑戦的研究開発課
TEL: 03-6870-6893
Email: moonshot*amed.go.jp
シーズ開発・基礎研究事業部挑戦的研究開発課
TEL: 03-6870-6893
Email: moonshot*amed.go.jp
※E-mailは*を@に置き換えてください。
お問い合わせ
東北大学 国際放射光イノベーション・スマート研究センター
〒980-8572 仙台市青葉区荒巻字青葉468−1


